 Развитие гипертрофического ожирения провоцирует снижение чувствительности периферических тканей к действию инсулина. Именно развитие хронического избытка инсулина в крови большинство исследователей считают “пусковой кнопкой” для возникновения всех заболеваний, входящих в понятие "метаболический синдром".
Развитие гипертрофического ожирения провоцирует снижение чувствительности периферических тканей к действию инсулина. Именно развитие хронического избытка инсулина в крови большинство исследователей считают “пусковой кнопкой” для возникновения всех заболеваний, входящих в понятие "метаболический синдром".
До настоящего времени не прекращается дискуссия о первичности или вторичности инсулинорезистентности и гиперандрогении при метаболическом синдроме.
Первая гипотеза
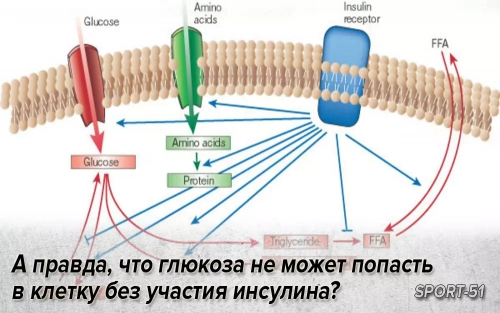
ИР — полигенная патология, в развитии которой могут иметь значение мутации генов субстрата инсулинового рецептора (IRS-1 и IRS-2), β3-адренорецепторов, разобщающего протеина (UCP-1), а также молекулярные дефекты белков сигнального пути инсулина (глюкозные транспортеры). Особую роль играет снижение чувствительности к инсулину в мышечной, жировой и печеночной тканях, а также в надпочечниках.
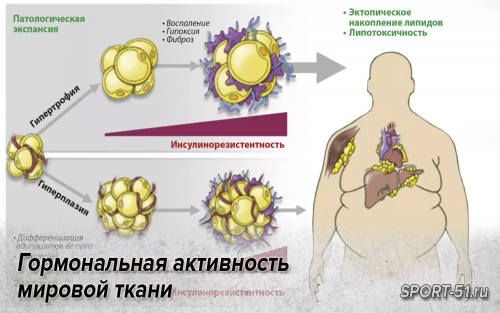
В миоцитах нарушаются поступление и утилизация глюкозы, в жировой ткани развивается резистентность к антилиполитическому действию инсулина. Интенсивный липолиз в висцеральных адипоцитах приводит к выделению большого количества свободных жирных кислот (СЖК) и глицерина в портальный кровоток. Поступая в печень, СЖК, с одной стороны, становятся субстратом для формирования атерогенных липопротеидов, а с другой — препятствуют связыванию инсулина с гепатоцитом, потенциируя ИР.
ИР гепатоцитов ведет к снижению синтеза гликогена, активации гликогенолиза и глюконеогенеза. Долгое время ИР компенсируется избыточной продукцией инсулина, поэтому нарушение гликемического контроля манифестирует не сразу. Но, по мере истощения функции β-клеток поджелудочной железы, наступает декомпенсация углеводного обмена, сначала в виде нарушенных гликемии натощак и толерантности к глюкозе (НТГ), а затем и сахарного диабета 2 типа (Т2СД).
Дополнительное снижение секреции инсулина при МС вызывается длительным воздействием высоких концентраций СЖК на β-клетки (так называемый липотоксический эффект). При имеющихся генетически обусловленных дефектах секреции инсулина развитие Т2СД значительно ускоряется.
Вторая гипотеза
Согласно другой гипотезе, ведущую роль в развитии и прогрессировании инсулинорезистентности играет жировая ткань абдоминальной области. Особенность висцеральных адипоцитов — высокая чувствительность к липолитическому действию катехоламинов и низкая к антилиполитическому действию инсулина.
Помимо веществ, непосредственно регулирующих липидный обмен, жировая клетка продуцирует эстрогены, цитокины, ангиотензиноген, ингибитор активатора плазминогена-1, липопротенлипазу, адипсин, адинопектин, интерлейкин-6, фактор некроза опухолей-α (ФНО-α), трансформирующий фактор роста В, лептин и др.
ФНО-α способен воздействовать на инсулиновый рецептор и транспортеры глюкозы, потенциируя инсулинорезистентность, и стимулировать секрецию лептина. Лептин («голос жировой ткани») регулирует пищевое поведение, воздействуя на гипоталамический центр насыщения; повышает тонус симпатической нервной системы; усиливает термогенез в адипоцитах; подавляет синтез инсулина; воздействует на инсулиновый рецептор клетки, снижая транспорт глюкозы.
При ожирении наблюдается лептинорезистентность. Полагают, что гиперлептинемия оказывает стимулирующее действие на некоторые гипоталамические релизинг-факторы (РФ), в частности на АКТГ-РФ. Так, при МС часто отмечается легкий гиперкортицизм, который играет определенную роль в патогенезе МС.